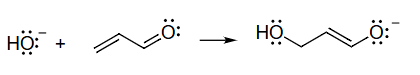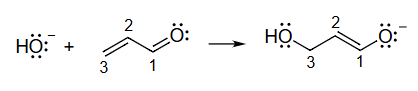Chapter2
极性共价键polar covalent bond由于电负性electronegativity差异而具有不对称的电子分布asymmetric electron distribution。
1 感应效应:
由于电负性差异引起的 σ \sigma σ
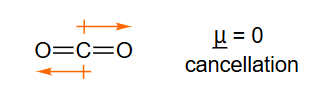
偶极矩:μ ‾ = Q r ‾ \underline{\mu}=\mathrm{Q} \underline{r} μ = Q r
偶极矩:
μ ‾ = Q r ‾ \underline{\mu}=\mathrm{Q} \underline{r} μ = Q r
N a + C l − \mathrm{Na}^{+} \mathrm{Cl}^{-} Na + Cl − 9.0 D
C H 3 C l \mathrm{CH}_{3} \mathrm{Cl} CH 3 Cl 1.87 D
H 2 O \mathrm{H}_{2} \mathrm{O} H 2 O 1.85 D
N H 3 \mathrm{NH}_{3} NH 3 1.47 D
C H 4 \mathrm{CH}_{4} CH 4 0
C O 2 \mathrm{CO}_{2} CO 2 0
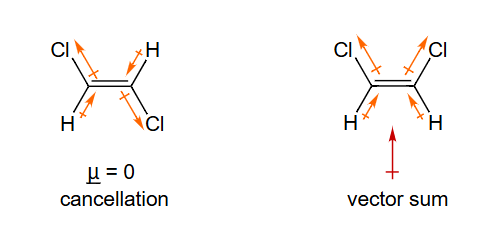
键偶极
μ ‾ ≈ \underline{\mu} \approx μ ≈ 键偶极 的矢量和
μ ‾ = 0 抵消 \underline{\mathrm{\mu}}=0\text { 抵消 } μ = 0 抵消
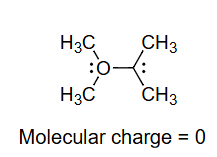
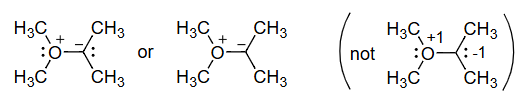
原子上的形式电荷FC是一种电子记账方法。化学反应涉及键合的变化,有一个计算电子的约定有助于理解和预测化学反应。我们的计数约定包括形式电荷和箭头表示法(本章后面讨论)。
Formal charge = ( No. of valence electrons in the free atom ) − ( No. of valence electrons in the bound atom ) = ( No. of valence electrons in the free atom ) − 1 2 ( No. of shared electrons ) − ( No. of nonbonding (lone pair) electrons ) \begin{aligned} \text { Formal charge } & =\binom{\text { No. of valence electrons }}{\text { in the free atom }}-\binom{\text { No. of valence electrons }}{\text { in the bound atom }} \\ & =\binom{\text { No. of valence electrons }}{\text { in the free atom }}-\frac{1}{2}\binom{\text { No. of shared }}{\text { electrons }}-\left(\begin{array}{l}\text { No. of nonbonding } \\ \text { (lone pair) electrons }\end{array}\right)\end{aligned} Formal charge = ( in the free atom No. of valence electrons ) − ( in the bound atom No. of valence electrons ) = ( in the free atom No. of valence electrons ) − 2 1 ( electrons No. of shared ) − ( No. of nonbonding (lone pair) electrons )
形式电荷 = ( 自由原子中的 价电子数 ) − ( 成键原子中的 价电子数 ) = ( 自由原子中的 价电子数 ) − 1 2 ( 共享 电子数 ) − ( 非键合(孤对) 电子数 ) N 5 − 1 2 ( 6 ) − 2 = 0 H 1 − 1 2 ( 2 ) − 0 = 0 \begin{aligned}
\text { 形式电荷 } &=\binom{\text { 自由原子中的 }}{\text { 价电子数 }}-\binom{\text { 成键原子中的 }}{\text { 价电子数 }} \\
& =\binom{\text { 自由原子中的 }}{\text { 价电子数 }}-\frac{1}{2}\binom{\text { 共享}}{\text { 电子数}}-\binom{\text { 非键合(孤对)}}{\text { 电子数 }} \\
& \mathbf{N} \quad 5-\frac{1}{2}(6)-2=0 \\
& \text{ H} \quad 1-\frac{1}{2}(2)-0=0
\end{aligned}
形式电荷 = ( 价电子数 自由原子中的 ) − ( 价电子数 成键原子中的 ) = ( 价电子数 自由原子中的 ) − 2 1 ( 电子数 共享 ) − ( 电子数 非键合(孤对) ) N 5 − 2 1 ( 6 ) − 2 = 0 H 1 − 2 1 ( 2 ) − 0 = 0
形式电荷 = 自由原子中的价电子数 − 成键原子中的价电子数
= 自由原子中的价电子数 − ½ (共享电子数)− 非键合(孤对)电子数
○1
N ¨ H 3 \ddot{\mathrm{N}} \mathrm{H}_3 N ¨ H 3
N 有 5 个价电子 valence electrons
H 有 1 个价电子 valence electron
N H 3 \mathrm{NH}_3 NH 3
N 5 − 1 2 ( 6 ) − 2 = 0 H 1 − 1 2 ( 2 ) − 0 = 0 \begin{array}{ll}\text { N } & 5-\frac{1}{2}(6)-2=0 \\\text { H } & 1-\frac{1}{2}(2)-0=0\end{array} N H 5 − 2 1 ( 6 ) − 2 = 0 1 − 2 1 ( 2 ) − 0 = 0
○2
分子电荷 = 0
C ( C H 3 ) 4 − 1 2 ( 8 ) − 0 = 0 O 6 − 1 2 ( 6 ) − 2 = + 1 C : 4 − 1 2 ( 6 ) − 2 = − 1 \begin{array}{cl}\mathrm{C}\left(\mathrm{CH}_3\right) & 4-\frac{1}{2}(8)-0=0 \\ \mathrm{O} & 6-\frac{1}{2}(6)-2=+1 \\ \mathrm{C}: & 4-\frac{1}{2}(6)-2=-1\end{array} C ( CH 3 ) O C : 4 − 2 1 ( 8 ) − 0 = 0 6 − 2 1 ( 6 ) − 2 = + 1 4 − 2 1 ( 6 ) − 2 = − 1
如何绘制:
○3
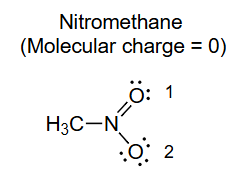
硝基甲烷
分子电荷 = 0
N 5 − 1 2 ( 8 ) − 0 = + 1 O 1 6 − 1 2 ( 4 ) − 4 = 0 O 2 6 − 1 2 ( 2 ) − 6 = − 1 \begin{array}{ll}\mathbf{N} & 5-\frac{1}{2}(8)-0=+1 \\ \mathbf{O}_1 & 6-\frac{1}{2}(4)-4=0 \\ \mathbf{O}_2 & 6-\frac{1}{2}(2)-6=-1\end{array} N O 1 O 2 5 − 2 1 ( 8 ) − 0 = + 1 6 − 2 1 ( 4 ) − 4 = 0 6 − 2 1 ( 2 ) − 6 = − 1
如何绘制:
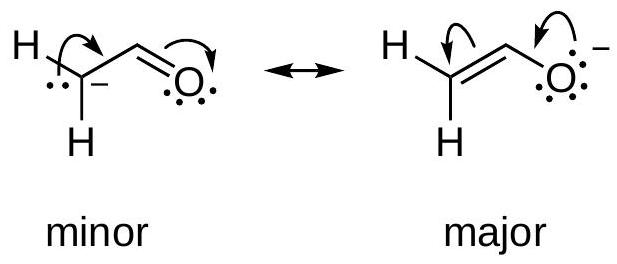
3 共振 Resonance
=不对称结构的等权重共振杂化体 equally weighted resonance hybrid
带有路易斯孤对的线键结构足以描述局域键合,但对于像硝基甲烷这种具有离域π键的分子则不行。上面不对称的电荷分布是不正确的,因为硝基甲烷已知是对称的,具有相等的 N-O 键长。为了使用线键结构和孤对正确描述硝基甲烷的波函数,我们需要这两个不对称结构的等权重共振杂化体:
⟷ \longleftrightarrow ⟷
硝基甲烷的波函数是:Ψ nitromethane = 1 2 ( Φ 1 + Φ 2 ) \Psi_{\text {nitromethane }}=\frac{1}{\sqrt{2}}\left(\Phi_{1}+\Phi_{2}\right) Ψ nitromethane = 2 1 ( Φ 1 + Φ 2 ) Φ 1 \Phi_{1} Φ 1 Φ 2 \Phi_{2} Φ 2 Ψ nitromethane \Psi_{\text {nitromethane }} Ψ nitromethane
因为共振结构指的是单一分子,所以所有共振结构的核位置nuclear positions必须相同。
4 共轭 Conjugation
共轭是指具有相邻碳原子上平行 p 轨道的离域 π \pi π π \pi π s p 2 \mathrm{sp}^{2} sp 2
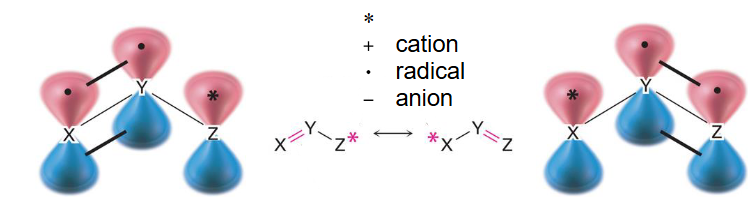
∗ * ∗
+cation 阳离子
● radical 自由基
-anion 阴离子
Allyl group ( C 3 H 5 ) : X , Y , Z = C \text { Allyl group }\left(\mathrm{C}_3 \mathrm{H}_5\right): \mathrm{X}, \mathrm{Y}, \mathrm{Z}=\mathrm{C} Allyl group ( C 3 H 5 ) : X , Y , Z = C
烯丙基(C 3 H 5 \mathrm{C}_3 \mathrm{H}_5 C 3 H 5
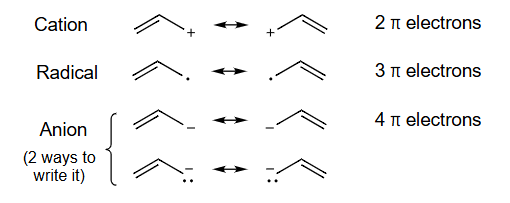
阳离子 Cation
自由基 Radical
阴离子Anion(有两种写法)(2 ways to write it)
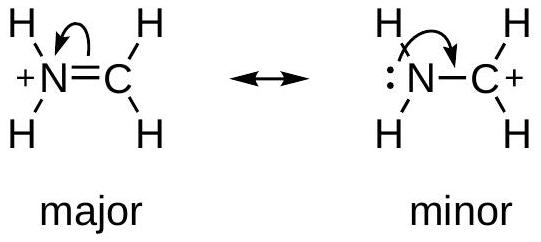
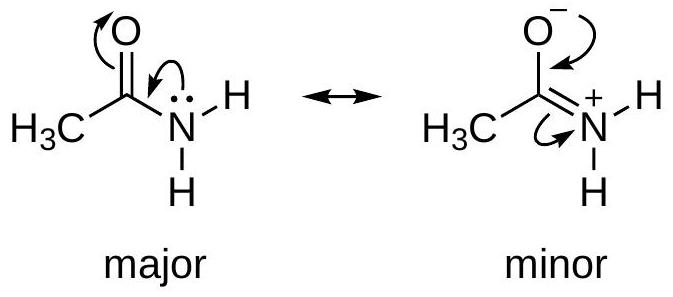
5 使用弯箭头生成共振结构
使用弯箭头生成共振结构
移动电子对,而非原子
从具有最强给电子能力的位点开始画箭头
○1
在带有负电荷的原子上的孤对
○2
在中性原子上的孤对
○3
在 π \pi π
在 C H 3 N O 2 \mathrm{CH}_{3} \mathrm{NO}_{2} CH 3 NO 2 不等的权重 。
6 识别主要共振结构
如何识别主要共振结构,按重要性排序:
○1
八隅体规则
○2
最小电荷分离
○3
负电荷应位于电负性更大的原子上
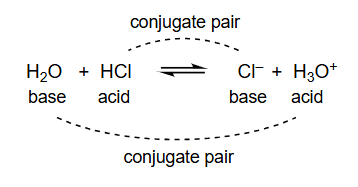
7 布朗斯特酸碱平衡
H 2 O base + H C l acid ⇌ C l − base + H 3 O + acid \underset{\text { base }}{\mathrm{H}_2 \mathrm{O}}+\underset{\text { acid }}{\mathrm{HCl}} \rightleftharpoons \underset{\text{base}}{\mathrm{Cl}^{-} }+ \underset{\text { acid }}{\mathrm{H}_3 \mathrm{O}^{+}} base H 2 O + acid HCl ⇌ base Cl − + acid H 3 O +
H 2 O 碱 + H C l 酸 ⇌ C l − 碱 + H 3 O + 酸 \underset{\text{碱}}{\mathrm{H}_2 \mathrm{O}} + \underset{\text{酸}}{\mathrm{HCl}} \rightleftharpoons \underset{\text{碱}}{\mathrm{Cl}^{-}} + \underset{\text{酸}}{\mathrm{H}_3 \mathrm{O}^{+}} 碱 H 2 O + 酸 HCl ⇌ 碱 Cl − + 酸 H 3 O +
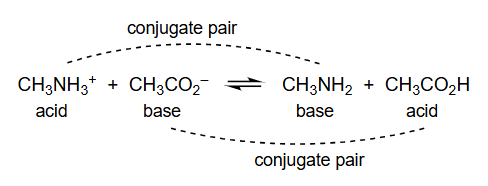
C H 3 N H 3 + acid + C H 3 C O 2 − base ⇌ C H 3 N H 2 base + C H 3 C O 2 H acid \underset{\text { acid }}{\mathrm{CH}_3 \mathrm{NH}_3^{+}}+\underset{\text { base }}{\mathrm{CH}_3 \mathrm{CO}_2^{-}} \rightleftharpoons \underset{\text { base }}{\mathrm{CH}_3 \mathrm{NH}_2}+\underset{\text { acid }}{\mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}} acid CH 3 NH 3 + + base CH 3 CO 2 − ⇌ base CH 3 NH 2 + acid CH 3 CO 2 H
C H 3 N H 3 + 酸 + C H 3 C O 2 − 碱 ⇌ C H 3 N H 2 碱 + C H 3 C O 2 H 酸 \underset{\text{酸}}{\mathrm{CH}_3 \mathrm{NH}_3^{+}} + \underset{\text{碱}}{\mathrm{CH}_3 \mathrm{CO}_2^{-}} \rightleftharpoons \underset{\text{碱}}{\mathrm{CH}_3 \mathrm{NH}_2} + \underset{\text{酸}}{\mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}} 酸 CH 3 NH 3 + + 碱 CH 3 CO 2 − ⇌ 碱 CH 3 NH 2 + 酸 CH 3 CO 2 H
8 酸强度通过 p K a \mathrm{pK}_{\mathrm{a}} pK a
C H 3 C O 2 H + H 2 O ⇌ C H 3 C O 2 − + H 3 O + \mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}+\mathrm{H}_2 \mathrm{O} \rightleftharpoons \mathrm{CH}_3 \mathrm{CO}_2^{-}+\mathrm{H}_3 \mathrm{O}^{+} CH 3 CO 2 H + H 2 O ⇌ CH 3 CO 2 − + H 3 O +
K e q = [ C H 3 C O 2 − ] [ H 3 O + ] [ C H 3 C O 2 H ] [ H 2 O ] \mathrm{K}_{\mathrm{eq}}=\frac{\left[\mathrm{CH}_3 \mathrm{CO}_2^{-}\right]\left[\mathrm{H}_3 \mathrm{O}^{+}\right]}{\left[\mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}\right]\left[\mathrm{H}_2 \mathrm{O}\right]} K eq = [ CH 3 CO 2 H ] [ H 2 O ] [ CH 3 CO 2 − ] [ H 3 O + ]
[ H 2 O ] K e q = [ C H 3 C O 2 − ] [ H 3 O + ] [ C H 3 C O 2 H ] = K a ( C H 3 C O 2 H ) = 0.000025 p K a ( C H 3 C O 2 H ) = − log K a ( C H 3 C O 2 H ) = 4.6 \begin{aligned} {\left[\mathrm{H}_2 \mathrm{O}\right] \mathrm{K}_{\mathrm{eq}}=\frac{\left[\mathrm{CH}_3 \mathrm{CO}_2^{-}\right]\left[\mathrm{H}_3 \mathrm{O}^{+}\right]}{\left[\mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}\right]} } & =\mathrm{K}_{\mathrm{a}}\left(\mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}\right) \\ & =0.000025 \\ \mathrm{pK}_{\mathrm{a}}\left(\mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}\right) & =-\log \mathrm{K}_{\mathrm{a}}\left(\mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}\right) \\ & =4.6\end{aligned} [ H 2 O ] K eq = [ CH 3 CO 2 H ] [ CH 3 CO 2 − ] [ H 3 O + ] pK a ( CH 3 CO 2 H ) = K a ( CH 3 CO 2 H ) = 0.000025 = − log K a ( CH 3 CO 2 H ) = 4.6
在任意溶剂中,K a ( C H 3 C O 2 H ) \mathrm{K}_{\mathrm{a}}\left(\mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H}\right) K a ( CH 3 CO 2 H )
C H 3 C O 2 H ⇌ C H 3 C O 2 − + H + \mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H} \rightleftharpoons \mathrm{CH}_3 \mathrm{CO}_2^{-}+\mathrm{H}^{+} CH 3 CO 2 H ⇌ CH 3 CO 2 − + H +
K a ( C H 3 C O 2 H ) = [ C H 3 C O 2 − ] [ H + ] [ C H 3 C O 2 H ] \mathrm{K}_{\mathrm{a}}\left(\mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}\right)=\frac{\left[\mathrm{CH}_3 \mathrm{CO}_2{ }^{-}\right]\left[\mathrm{H}^{+}\right]}{\left[\mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}\right]} K a ( CH 3 CO 2 H ) = [ CH 3 CO 2 H ] [ CH 3 CO 2 − ] [ H + ]
H + \mathrm{H}^{+} H + H 3 O + \mathrm{H}_{3} \mathrm{O}^{+} H 3 O +
Conjugate Acid
pKa
Conjugate Base
Weakest Acid →
NH₃
35
NH₂⁻
←Strongest Base
H₂O
16
OH⁻
CH₃CH₂OH
16
CH₃CH₂O⁻
NH₄⁺
10
NH₃
HCN
9
CN⁻
CH₃CO₂H
5
CH₃CO₂⁻
HF
3
F⁻
H₃O⁺
-1
H₂O
Strongest Acid
HCl
-7
Cl⁻
←Weakest Base
共轭酸
pKa
共轭碱
最弱酸 →
NH₃(氨)
35
NH₂⁻(氨负离子)
← 最强碱
H₂O(水)
16
OH⁻(氢氧根)
CH₃CH₂OH(乙醇)
16
CH₃CH₂O⁻(乙醇负离子)
NH₄⁺(铵离子)
10
NH₃(氨)
HCN(氢氰酸)
9
CN⁻(氰离子)
CH₃CO₂H(乙酸)
5
CH₃CO₂⁻(乙酸根)
HF(氢氟酸)
3
F⁻(氟离子)
H₃O⁺(水合氢离子)
-1
H₂O(水)
最强酸
HCl(盐酸)
-7
Cl⁻(氯离子)
← 最弱碱
9 酸碱平衡的哪一侧浓度更高?=哪一侧的自由能更低?
步骤:比较共轭酸的 p K a \mathrm{pK}_{\mathrm{a}} pK a
浓度更高=自由能更低
浓度最高的分子
=最弱的酸+最弱的碱
=热力学上最稳定的物种
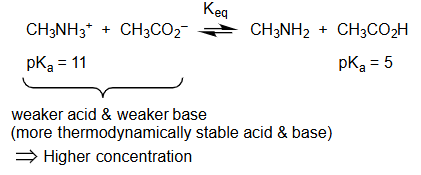
C H 3 N H 3 + p K a = 11 + C H 3 C O 2 − ⇌ K e q C H 3 N H 2 + C H 3 C O 2 H p K a = 5 \begin{aligned} & \underset{\mathrm{pK}_{\mathrm{a}}=11}{\mathrm{CH}_3 \mathrm{NH}_3^{+}}+\mathrm{CH}_3 \mathrm{CO}_2^{-} \stackrel{\mathrm{K}_{\mathrm{eq}}}{\rightleftharpoons} \mathrm{CH}_3 \mathrm{NH}_2+\underset{\mathrm{pK}_{\mathrm{a}}=5}{\mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}} \end{aligned} pK a = 11 CH 3 NH 3 + + CH 3 CO 2 − ⇌ K eq CH 3 NH 2 + pK a = 5 CH 3 CO 2 H
C H 3 N H 3 + + C H 3 C O 2 − \mathrm{CH}_3 \mathrm{NH}_3^{+}+\mathrm{CH}_3 \mathrm{CO}_2^{-} CH 3 NH 3 + + CH 3 CO 2 −
=p K a = 11 \mathrm{pK}_{\mathrm{a}}=11 pK a = 11
= 较弱的酸 和 较弱的碱 weaker acid & weaker base
= 热力学上更稳定的酸和碱 weaker acid & weaker base
= 较高浓度 Higher concentration
K e q = [ C H 3 N H 2 ] [ C H 3 C O 2 H ] [ C H 3 N H 3 + ] [ C H 3 C O 2 − ] = 1 0 Δ p K a \mathrm{K}_{\mathrm{eq}}=\frac{\left[\mathrm{CH}_3 \mathrm{NH}_2\right]\left[\mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}\right]}{\left[\mathrm{CH}_3 \mathrm{NH}_3^{+}\right]\left[\mathrm{CH}_3 \mathrm{CO}_2^{-}\right]}=10^{\Delta \mathrm{pKa}} K eq = [ CH 3 NH 3 + ] [ CH 3 CO 2 − ] [ CH 3 NH 2 ] [ CH 3 CO 2 H ] = 1 0 Δ pKa
○ K eq = 1 0 Δ p K a \mathrm{K}_{\text {eq }}=10^{\Delta \mathrm{pKa}} K eq = 1 0 Δ pKa
考虑两个酸的 K a \mathrm{K}_{\mathrm{a}} K a
C H 3 N H 3 + ⇌ C H 3 N H 2 + H + K a ( C H 3 N H 3 + ) = [ C H 3 N H 2 ] [ H + ] [ C H 3 N H 3 + ] C H 3 C O 2 H ⇌ C H 3 C O 2 − + H + K a ( C H 3 C O 2 H ) = [ C H 3 C O 2 − ] [ H + ] [ C H 3 C O 2 H ] \begin{array}{ll}
\mathrm{CH}_{3} \mathrm{NH}_{3}^{+} \rightleftharpoons \mathrm{CH}_{3} \mathrm{NH}_{2}+\mathrm{H}^{+} & \mathrm{Ka}\left(\mathrm{CH}_{3} \mathrm{NH}_{3}^{+}\right)=\frac{\left[\mathrm{CH}_{3} \mathrm{NH}_{2}\right]\left[\mathrm{H}^{+}\right]}{\left[\mathrm{CH}_{3} \mathrm{NH}_{3}^{+}\right]} \\
\mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H} \rightleftharpoons \mathrm{CH}_{3} \mathrm{CO}_{2}^{-}+\mathrm{H}^{+} & \mathrm{K}_{\mathrm{a}}\left(\mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H}\right)=\frac{\left[\mathrm{CH}_{3} \mathrm{CO}_{2}^{-}\right]\left[\mathrm{H}^{+}\right]}{\left[\mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H}\right]}
\end{array}
CH 3 NH 3 + ⇌ CH 3 NH 2 + H + CH 3 CO 2 H ⇌ CH 3 CO 2 − + H + Ka ( CH 3 NH 3 + ) = [ CH 3 NH 3 + ] [ CH 3 NH 2 ] [ H + ] K a ( CH 3 CO 2 H ) = [ CH 3 CO 2 H ] [ CH 3 CO 2 − ] [ H + ]
K e q = [ C H 3 N H 2 ] [ C H 3 C O 2 H ] [ C H 3 N H 3 + ] [ C H 3 C O 2 − ] (根据定义) = [ C H 3 N H 2 ] [ H + ] [ C H 3 C O 2 H ] [ C H 3 N H 3 + ] [ C H 3 C O 2 − ] [ H + ] = K a ( C H 3 N H 3 + ) K a ( C H 3 C O 2 H ) = 1 0 − p K a ( C H 3 N H 3 + ) 1 0 − p K a ( C H 3 C O 2 H ) = 1 0 − ( 11 − 5 ) = 1 0 − 6 \begin{aligned}
\mathrm{K}_{\mathrm{eq}}= & \frac{\left[\mathrm{CH}_{3} \mathrm{NH}_{2}\right]\left[\mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H}\right]}{\left[\mathrm{CH}_{3} \mathrm{NH}_{3}^{+}\right]\left[\mathrm{CH}_{3} \mathrm{CO}_{2}^{-}\right]} \text {(根据定义) } \\
= & \frac{\left[\mathrm{CH}_{3} \mathrm{NH}_{2}\right]\left[\mathrm{H}^{+}\right]\left[\mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H}\right]}{\left[\mathrm{CH}_{3} \mathrm{NH}_{3}^{+}\right]\left[\mathrm{CH}_{3} \mathrm{CO}_{2}^{-}\right]\left[\mathrm{H}^{+}\right]}\\
=&\frac{\mathrm{K}_{\mathrm{a}}\left(\mathrm{CH}_{3} \mathrm{NH}_{3}^{+}\right)}{\mathrm{K}_{\mathrm{a}}\left(\mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H}\right)}\\
=&\frac{10^{-\mathrm{pK}_{\mathrm{a}}\left(\mathrm{CH}_{3} \mathrm{NH}_{3}^{+}\right)}}{10^{-\mathrm{pK}_{\mathrm{a}}\left(\mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H}\right)}}\\
=&10^{-(11-5)}\\
=&10^{-6} \\
\end{aligned}
K eq = = = = = = [ CH 3 NH 3 + ] [ CH 3 CO 2 − ] [ CH 3 NH 2 ] [ CH 3 CO 2 H ] (根据定义) [ CH 3 NH 3 + ] [ CH 3 CO 2 − ] [ H + ] [ CH 3 NH 2 ] [ H + ] [ CH 3 CO 2 H ] K a ( CH 3 CO 2 H ) K a ( CH 3 NH 3 + ) 1 0 − pK a ( CH 3 CO 2 H ) 1 0 − pK a ( CH 3 NH 3 + ) 1 0 − ( 11 − 5 ) 1 0 − 6
● p K a = − log K a ●\mathrm{pK}_{\mathrm{a}}=-\log \mathrm{K}_{\mathrm{a}} ● pK a = − log K a
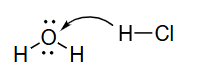
10 使用弯箭头来描绘反应中键合的变化并跟踪电子对
H 2 O + H C l ⇌ H 3 O + + C l − \mathrm{H}_{2} \mathrm{O}+\mathrm{HCl} \rightleftharpoons \mathrm{H}_{3} \mathrm{O}^{+}+\mathrm{Cl}^{-}
H 2 O + HCl ⇌ H 3 O + + Cl −
使用弯箭头来描绘反应中键合bonding的变化并跟踪电子对electron pairs
●移动电子对,而非原子
从具有最强给电子能力的位点开始画箭头:
○1
在带有负电荷的原子上的孤对
○2
在中性原子上的孤对
○3
在 π \pi π
正向反应 Forward reaction
逆向反应 Backward reaction
错误示例1:
应该移动电子对,而非原子
错误示例2:
11 绘制弯箭头以显示该反应中的键合变化bonding changes
步骤:
○1
在产物product中找到反应物原子reactant atoms
○2
确定反应过程中形成和断裂的键
○3
绘制弯箭头以显示电子对的移动。
○4
补上孤对电子,可能还有 C − H \mathrm{C}-\mathrm{H} C − H C − H \mathrm{C}-\mathrm{H} C − H
○5
编号通常有帮助
形成的键
H O − C 3 σ C 1 − C 2 π \begin{gathered}\\ \mathrm{HO}-\mathrm{C} 3 \sigma \\ \mathrm{C} 1-\mathrm{C} 2 \pi\end{gathered} HO − C 3 σ C 1 − C 2 π
断裂的键
C 2 − C 3 π C 1 − O π \begin{aligned}& \mathrm{C} 2-\mathrm{C} 3 \pi \\& \mathrm{C} 1-\mathrm{O} \pi\end{aligned} C 2 − C 3 π C 1 − O π
12 弯箭头的标注
a 从这里开始,因为 O H − \mathrm{OH}^{-} OH − π \pi π
13 弯箭头,1924
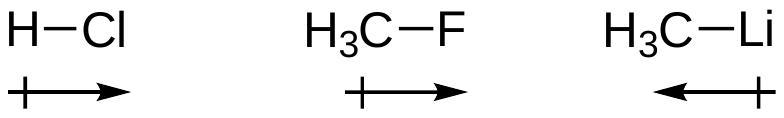

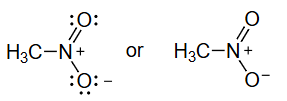
 符号 " " 表示共振,而非平衡。
符号 " " 表示共振,而非平衡。